2024年5月17日,欧盟发布了第八次医疗器械和体外诊断医疗器械获证申请与证书情况调查报告,提供了截至2024年2月29日的详尽数据。该报告的核心目的在于监控欧盟市场上医疗器械认证的相关数据,并评估医疗器械法规(MDR)和体外诊断医疗器械法规(IVDR)的实施效果。

MDR申请与发证情况:
截至2024年2月,MDR的申请数量已达到20,424件,发证数量为6,978张,相较于2023年6月的13,000件申请和3,899张证书,显示出显著增长。
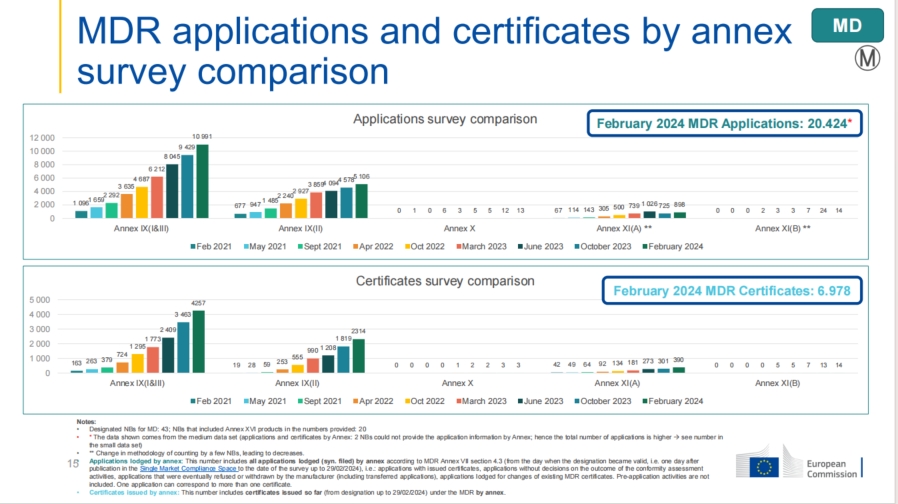
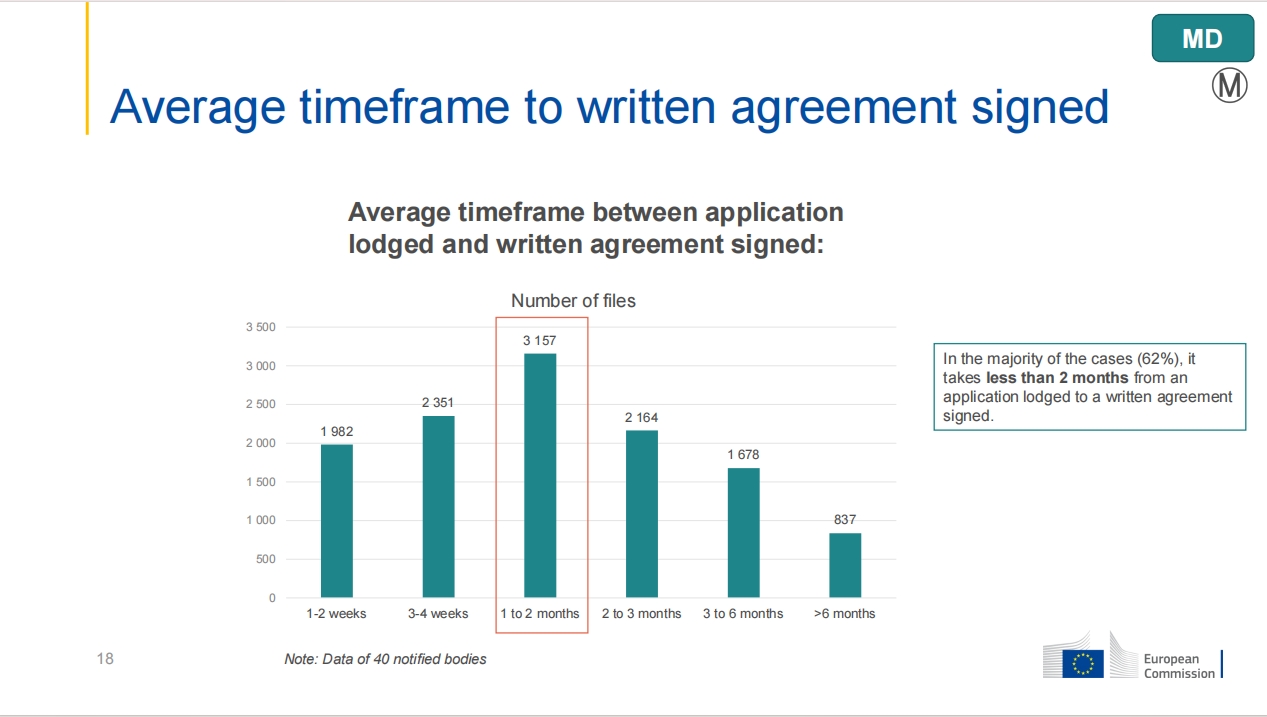
尽管申请数量和发证数量均有所增加,但公告机构(NBs)对合同评审的时间并未显著缩短,约26%项目从提出申请到签订合同所需时间仍需1至2个月。
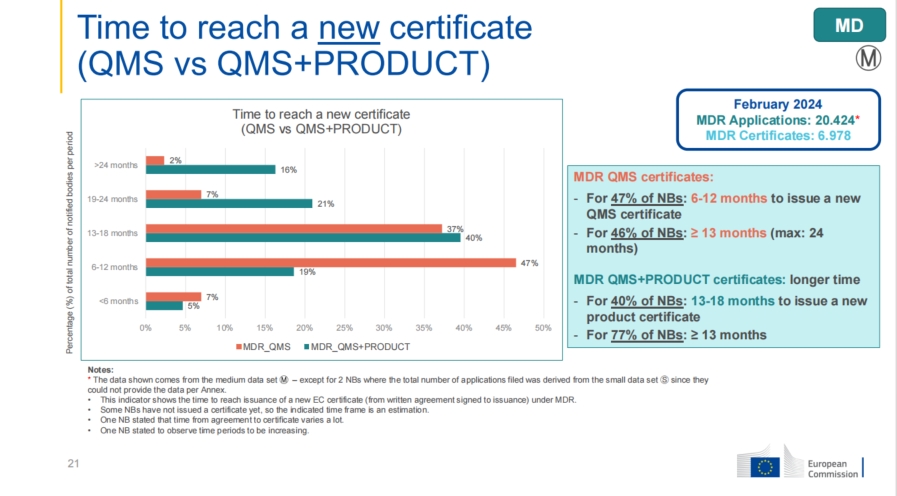
发证周期方面,77%的公告机构表示需要超过13个月的时间来颁发MDR证书,指出发证效率的提升尚需进一步改进。
IVDR申请与发证情况:
截至2024年2月,IVDR的申请数量为1,634件,发证数量达到798张,相较于2023年6月的1,155件申请和500张证书相比,亦有显著提升。
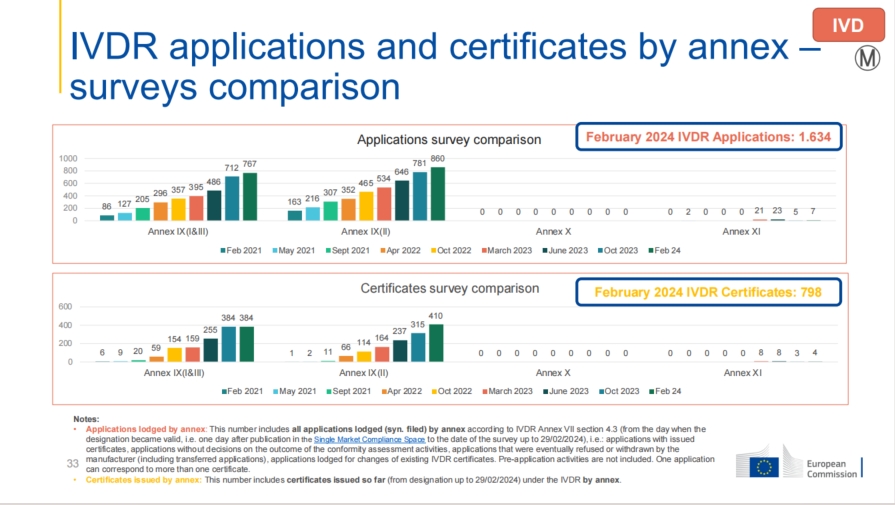
与MDR情况相似,IVDR的发证周期同样较长,75%的公告机构预计需要13至18个月来颁发证书。

报告通过提供不同类型的证书数量、获证周期的统计数据和市场动态的综合研究,为相关行业提供了重要的参考和指导。它揭示了公告机构正在逐步提高医疗器械认证效率,同时也揭示了申请数量的显著增长,这反映了市场对于MDR和IVDR认证的强烈需求。然而,这一增长也带来了额外的压力,尤其是在公告机构的资源分配和处理能力上。因此,制造商需要进一步采取措施,以确保能够及时响应市场需求,同时保持认证过程的质量和效率。
目前,我们能够清晰地观察到欧盟在医疗器械认证领域所做的全面努力,以及其在提高流程透明度方面的持续进步。希望在未来欧盟可以提供更多的支持和指导,降低注册周期,方便更多的制造商获得CE认证,进入欧盟市场。





 沪公网安备 310114020088*8号
沪公网安备 310114020088*8号