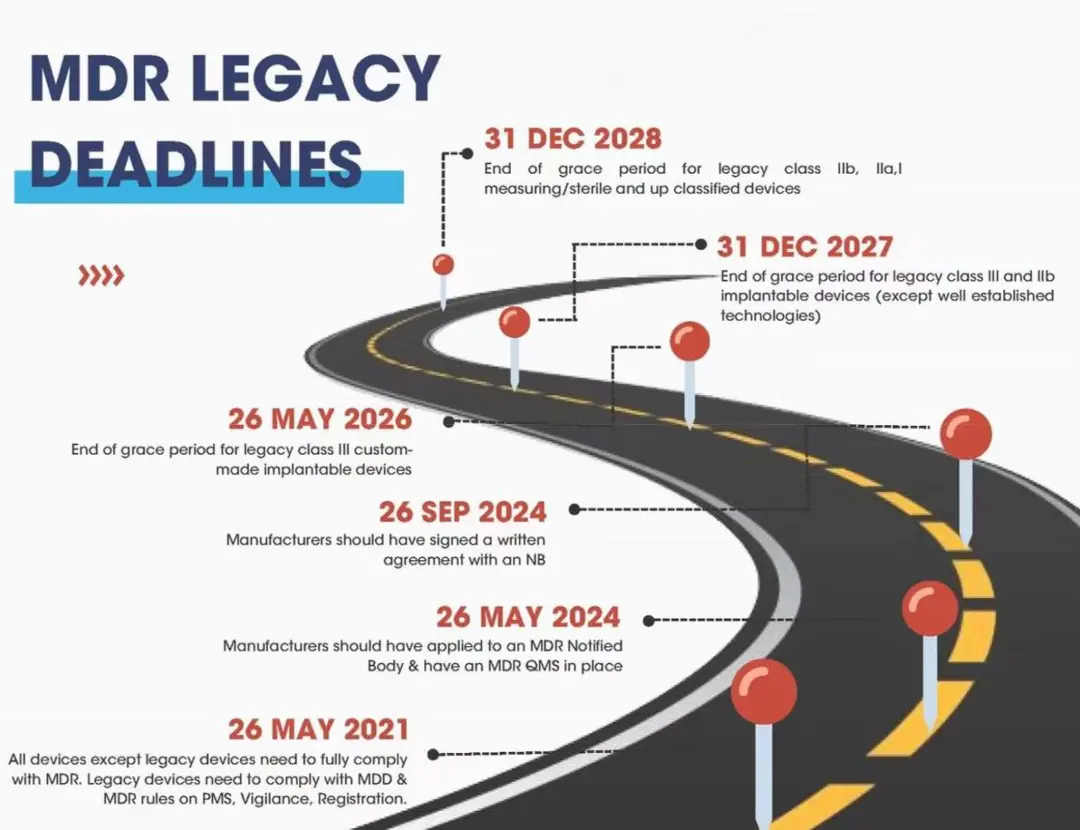
遗留器械可以在未完全获得MDR合格评定符合性证书的情况下合法地在欧洲市场上流通,直至2026年5月26日,前提是这些遗留器械的制造商在2024年5月26日前向公告机构递交了正式申请,并且于2024年9月26日前与公告机构签署书面协议。
MDR法规在第120条作了规定,明确了制造商必须遵循的关键事项,以继续在欧盟市场上投放符合先前指令的设备。总体而言,对遗留器械的要求主要包括:
在2024年5月26日之前提交MDR申请
在2024年5月26日之前实施质量管理体系(QMS)
确保器械符合适用指令(MDD或AIMDD)
器械的设计或预期用途没有重大变化
确保器械不会对健康或安全构成任何不可接受的风险
遵守MDR对运营商和器械的上市后监督、警戒和注册的要求
医疗器械指令的公告机构在2024年9月26日之前为器械实行监督工作,然而在此之后,如果制造商变更了MDR公告机构,那么指令的公告机构将不再继续履行监督工作。也就是说,签署协议的MDR公告机构最迟将在2024年9月26日,开始实施对这些遗留器械的监督工作。





 沪公网安备 310114020088*8号
沪公网安备 310114020088*8号