MDR
由于器械不接触心脏以及中枢神经系统,在MDR下分为IIb类医疗器械。由于该器械在国内免临床,一般企业不会进行临床试验,所以临床评价路径通常用等同路径。当然如果有创新的技术或者比同类器械更多的适应症,则需要考虑通过自持有临床数据(临床试验)的方式上市。
*如果消融器械的适应症包含心脏及中枢系统,则分为III类,一般情况下需要临床试验证据。
临床前测试证据:能量消融设备的临床前测试通常包括生物相容性,安规/EMC,软件,有效期,性能测试(包括体外和体内动物实验, 离体试验),生物相容性,包装运输,无菌,兼容性,测温准确度等
FDA
普通适应症的能量消融系统在FDA分为II类,上市途径为510(k)。大多数情况下只需要在FDA已获批510k的数据库中找到合适的等同器械并证明等同,无需进行临床试验。
*如果产品的预期用途声称为普通软组织,则只需提交离体试验。如果涉及到特殊软组织(包括肺,结肠直肠组织,皮肤,粘膜,神经组织),则须考虑动物实验。详见 FDA Guidance Premarket Notification (510(K)) Submissions for Electrosurgical Devices for General Surgery
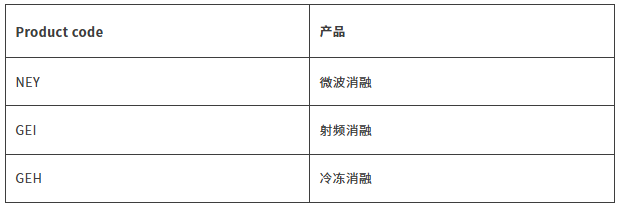
中国
微波消融设备分类编码为01-04-01,按第三类医疗器械管理。详见《微波消融设备注册审查指导原则》
射频消融设备分类编码为1-03-02,按第三类医疗器械管理。
冷冻消融设备按第三类医疗器械管理






 沪公网安备 310114020088*8号
沪公网安备 310114020088*8号